Manish Vira, urologue à Northwell Health à New York, effectue des biopsies de la prostate trois à cinq fois par semaine. Il insère 12 aiguilles dans la prostate à des endroits précis, identifiés par des images IRM qui révèlent des lésions malignes ou suspectes. Les échantillons sont ensuite transmis à un pathologiste qui détermine si le cancer est présent et à quel point il est agressif. “C’est un protocole standard”, explique Vira, oncologue en chef à Northwell.

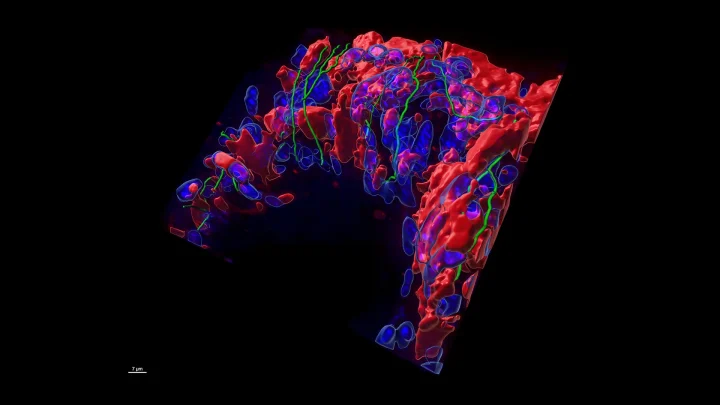
Les cellules cancéreuses de la prostate, en rouge, envahissent les cellules saines du foie, vues ici en bleu. Les nerfs environnants, surlignés en vert, peuvent avoir été utilisés par les cellules cancéreuses pour se déplacer de la prostate au foie. Crédit image : CSHL
Cependant, ce protocole standard comportait quelques étapes supplémentaires au cours des dernières années. Maintenant, le « lavage » de la biopsie – une collection de molécules lavées de l’échantillon – va au laboratoire de recherche de Lloyd Trotmannprofesseur au Cold Spring Harbor Laboratory (CSHL), qui étudie ce que rend ces tumeurs agressives ou aide leurs métastases.
L’équipe de Trotman examine les signatures génomiques des tumeurs, leur constitution génétique, qui peut les rendre plus ou moins agressives. Ils examinent les microenvironnements des tumeurs, les molécules dont le cancer s’entoure. Et tout en recherchant ces facteurs, ils creusent également quelque chose qui est rarement examiné dans la biologie du cancer : le système nerveux et son rôle dans la propagation des tumeurs.
Au cours de la dernière décennie, les scientifiques ont réalisé que le cancer n’est pas qu’une maladie localisée, mais un problème systémique qui implique tout l’organisme. Ils ont réalisé que les tumeurs n’existent pas dans le vide, mais nécessitent un environnement permissif et favorable pour s’installer et prospérer.
Pour ce faire, les tumeurs créent leurs propres écosystèmes, dans lesquels elles recrutent et reprogramment les propres cellules du corps, parfois même celles qui sont censées détruire le cancer, pour les aider à se développer et à se déplacer vers de nouveaux endroits. Ce qui est moins compris, c’est le rôle que jouent les nerfs dans ces interactions physiologiques complexes, dit Jérémy Bornigerégalement maître de conférences à Centre de cancérologie CSHL, qui travaille avec Trotman. Dans le scénario compliqué de la façon dont les tumeurs naissent et se métastasent, le système nerveux n’a pas reçu l’attention qu’il mérite.
“Si vous regardez n’importe quel article de synthèse sur le cancer datant d’il y a environ cinq ou six ans, vous voyez que la recherche a été hyper concentrée sur les oncogènes, le microenvironnement tumoral – les cellules cancéreuses, les cellules immunitaires, les cellules endothéliales, les fibroblastes, peut-être un couple d’autres types de cellules », explique Borniger. Cette image biologique est bien sûr importante, mais pas complète. «Les nerfs ne sont presque jamais mentionnés. Donc, ce qui manquait à l’équation, c’est comment la tumeur interagit avec le corps à l’échelle physiologique, comme avec le système nerveux.
Trotman et Borniger tentent de voir le cancer comme une maladie globale, dans laquelle le cerveau (l’unité centrale de traitement) et le système nerveux (ses canaux de communication) occupent une place importante dans la progression du cancer – peut-être même la dernière frontière dans notre compréhension de cette maladie. Pour commencer, aucun organe ne peut exister sans être «innervé», c’est-à-dire desservi et assisté par des nerfs, qui transmettent des signaux dans les deux sens depuis le cerveau, affectant directement le fonctionnement de cette partie du corps.
Le cerveau, pour sa part, est le maître régulateur du corps, coordonnant tous les processus chimiques qui se produisent à l’intérieur de nous. Le cerveau recueille les informations sur le corps par le biais du système nerveux et via des signaux chimiques circulant dans le sang. Ensuite, il interprète les informations et renvoie des messages chimiques aux neurones qui les transmettent aux organes, aux muscles et aux glandes, pour surveiller et influencer l’activité de ces tissus.
“Le système nerveux contrôle tout dans les tissus normaux – la croissance ou l’atrophie, ou n’importe quoi d’autre”, explique Massimo Loda, pathologiste moléculaire au Weill Cornell Medical Center à New York. Il y a donc des raisons de croire que la même chose se produit avec les tumeurs malignes. “Le tissu cancéreux se développe rapidement, il a donc besoin du soutien du système nerveux”, explique Loda. Par ailleurs, les scientifiques savent que certains cancers ont une prédilection particulière pour les nerfs. “Par exemple, les tumeurs du sein et de la prostate ont tendance à rechercher des nerfs et à envahir et à traverser ces nerfs”, explique Loda. C’est comme s’il y avait des relations obscures entre les terminaisons nerveuses et les tumeurs. “Cela suggère qu’il y a une synergie là-bas.”
Les connaissances observationnelles suggèrent qu’un plus grand nombre de nerfs autour d’une tumeur signale un pronostic plus sombre. Par exemple, lorsque les pathologistes évaluent la gravité du cancer de la prostate, le nombre de nerfs qui entourent ces tissus entre en ligne de compte. situation urgente », explique Borniger. “Pour nous, cela ressemble à un angle mort ou à un chaînon manquant.”
On ne sait pas vraiment pourquoi les nerfs et leur implication dans le cancer ont langui dans l’obscurité scientifique pendant si longtemps, mais les scientifiques ont quelques idées. Aussi étrange que cela puisse paraître, le système nerveux périphérique était le beau-fils des manuels d’anatomie.
Dans Grey’s Anatomy– la bible médicale écrite par le docteur anglais Henry Gray en 1858, qui éduque encore des générations de médecins – les nerfs et leurs relations avec certains organes restent quelque peu une réflexion après coup. « J’ai décidé de lire l’actuelle 42e édition de Grey’s Anatomy, et c’est une image intéressante », dit Trotman. “Pour le foie, un site de métastases prostatiques en phase terminale, vous voyez des descriptions et des représentations de toutes sortes de cellules, de toutes sortes de conduits et de vaisseaux sanguins, mais à ce jour, les nerfs ne sont généralement pas représentés. L’innervation de certains organes n’est apparemment pas un sujet majeur dans l’anatomie des organes.
La science moderne accorde beaucoup plus d’attention au système nerveux et au cerveau que le manuel vieux de 150 ans. En 2016, l’Allen Institute for Brain Science avait publié une carte de l’ensemble du cerveau humain, un atlas numérique de notre unité centrale de traitement. Un effort de 2021 a préservé, tranché et imagé un fragment chirurgical humain d’un cortex cérébral. Et pourtant, le système nerveux périphérique, qui est le conduit entre le cerveau et le reste du corps, n’est pas encore complètement défini. “Nous n’avons pas vraiment de grandes cartes du système nerveux périphérique et de la manière dont il relie le cerveau à ces organes”, déclare Borniger.
Une autre raison de cette étrange déconnexion est que, traditionnellement, les neuroscientifiques parlaient rarement aux biologistes du cancer. “Les neuroscientifiques ne travaillent généralement pas sur le cancer et les biologistes du cancer ne travaillent généralement pas sur les questions de neurosciences”, déclare Borniger. Historiquement, les deux disciplines sont restées trop éloignées l’une de l’autre et trop cloisonnées à l’intérieur de leurs dominions respectifs.
“C’est ce que nous essayons de changer”, déclare Trotman, en fusionnant essentiellement les deux domaines pour étudier les neurosciences du cancer. Dans ce domaine, la prostate est un sujet de recherche particulièrement intéressant, explique-t-il. “La prostate est une glande, ce qui signifie qu’elle est déjà entourée de nombreux nerfs”, dit-il. “Le système nerveux contrôle le fonctionnement de la glande, comme l’extraction de liquides. Il est donc déjà organisé de manière à se prêter à nos recherches. Et, grâce aux nouveaux outils mis à la disposition des scientifiques au cours des deux dernières décennies, ils sont désormais en mesure de jeter un coup d’œil en temps réel sur ces relations obscures entre les nerfs et les tumeurs.
Plusieurs percées technologiques majeures rendent possible la visualisation de l’interaction entre les nerfs et les tumeurs. L’un d’eux était l’utilisation de technologies fluorescentes qui permettaient aux scientifiques de concevoir des tissus pour qu’ils brillent d’une certaine couleur – rouge, vert, bleu. Les outils optogénétiques qui permettent aux chercheurs de manipuler l’activité des neurones avec la lumière constituent une autre avancée majeure pour jeter un coup d’œil dans les réseaux enchevêtrés de nerfs, de neurones et d’axones.
Grâce à ces technologies, les souris peuvent être conçues de manière à ce que chaque fois qu’une tumeur se développe naturellement en elles, elle devienne fluorescente, par exemple en rouge. “Cela signifie que tous les descendants de ces cellules cancéreuses brilleront également en rouge partout où ils iront”, explique Trotman, ce qui donne aux chercheurs un moyen de voir comment les métastases se propagent et s’installent.
De même, les souris peuvent être conçues pour avoir des organes innervés par des nerfs d’un vert chatoyant ou d’une autre teinte. Cela donne aux chercheurs une occasion sans précédent de voir comment les nerfs et les tumeurs interagissent. “Avec ces outils, nous pouvons étiqueter tous les nerfs qui innervent un organe particulier”, explique Trotman. “Et puis nous pouvons voir les nerfs verts et les cellules tumorales rouges, et comment ils interagissent.”

L’ingénierie des cellules cancéreuses, vues ici en rouge, pour qu’elles brillent d’une certaine couleur permet aux chercheurs de suivre leur propagation et leur interaction avec les tissus et les nerfs environnants, colorés ici en vert. Crédit image : CSHL
Peut-être plus important encore, ces techniques de visualisation peuvent aider à révéler les lacunes des traitements existants et à en développer de meilleurs. Par exemple, les médicaments de référence actuels pour le cancer de la prostate – les médicaments dits de castration chimique qui arrêtent la production d’hormones sexuelles – font rétrécir les tumeurs, mais seulement pendant un certain temps.
“C’est une régression temporaire, après quoi la rechute est garantie”, dit Trotman – et les médecins ne savent pas pourquoi. Les souris brillantes peuvent aider à faire la lumière là-dessus. “Nous voulons savoir ce qui arrive aux nerfs périphériques qui sont proches de la tumeur”, explique Trotman. Comment la tumeur qui rétrécit rebondit-elle? Stimule-t-il la croissance nerveuse? Est-il capable d’obtenir plus de nutriments en conséquence ? “Ce sont les questions auxquelles nous aimerions trouver des réponses.”
Ce travail peut finalement aider à répondre à d’autres questions déroutantes sur les causes du cancer. “Par exemple, le cancer de la prostate est beaucoup plus répandu chez les hommes de grande taille”, partage Massimo, probablement parce qu’il a quelque chose à voir avec les hormones de croissance qui proviennent du cerveau. La tumeur détourne-t-elle en quelque sorte les hormones de croissance pour son propre bénéfice ? Les nerfs sont-ils impliqués ? Si oui, les scientifiques peuvent-ils concevoir des médicaments qui interfèrent avec ce processus ? On peut peut-être aussi répondre à certaines de ces questions.
En ce qui concerne la gravité et le pronostic, les risques de cancer de la prostate peuvent être trompeurs. Comparé à de nombreuses autres tumeurs malignes agressives comme les tumeurs cérébrales ou pancréatiques, le cancer de la prostate ne se propage généralement pas ou ne tue pas rapidement – de nombreux hommes vivent 10 ans et même plus après leur diagnostic. Mais parce que c’est si courant – environ 12,5% des hommes l’obtiennent, selon les National Institutes of Health – dans l’ensemble, cela prend beaucoup de vies. En 2019, 224 733 cas ont été signalés et 31 636 hommes y ont succombé.
“Le problème est qu’il est si répandu”, dit Trotman. « Puisque seulement 5 à 10 % des personnes qui en sont atteintes développeront un cancer de la prostate métastatique, un patient moyen a 90 % de chances d’aller bien. Mais parce que tant d’hommes le développent, c’est toujours la deuxième cause de décès par cancer chez les hommes, après le cancer du poumon. Donc, si nous pouvons prévenir ou réduire les occurrences de la maladie métastatique, nous pouvons sauver de nombreuses personnes.
La source: CSHL