Deux articles de chercheurs de l’Université de Buffalo révèlent de nouvelles découvertes importantes sur l’échec de la régénération de la myéline dans la sclérose en plaques et, potentiellement, sur des moyens plus efficaces de la traiter. Les résultats comprennent la première démonstration qu’un médicament existant, actuellement à l’étude en tant que traitement anticancéreux, peut modifier les principales cascades de signalisation qui entraînent la SEP.
Publié dans le Journal des neurosciences et dans Nature Communications, la recherche préclinique sur des modèles murins de SEP rapporte la découverte d’une seule cible pharmacologique qui peut influencer plusieurs voies à la fois, interférant potentiellement avec les nombreuses causes de la SEP avec un seul médicament.

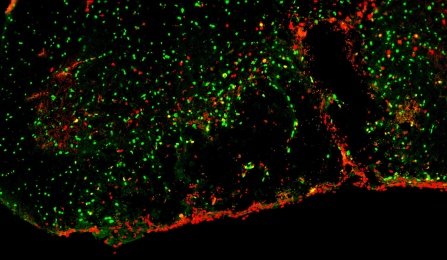
L’environnement tissulaire enflammé après la démyélinisation empêche le recrutement des cellules progénitrices d’oligodendrocytes (OPC) (vert) et arrête leur division (rouge). Ceci peut être surmonté par un traitement avec PI-88, un modulateur de l’héparanome. Crédit d’image: Darpan Saraswat
La matrice (extracellulaire)
Les résultats de l’UB soulignent le rôle important que joue la matrice extracellulaire dans la démyélinisation du cerveau, caractéristique de la SEP. Décrite comme une sorte d’échafaudage non cellulaire pour tous les tissus et organes, la matrice extracellulaire joue un rôle essentiel dans le lancement de nombreuses cascades de signalisation biochimiques et spécifiques aux tissus. Dans le cerveau, cela inclut les personnes responsables de la régulation de la réparation de la myéline, l’isolant graisseux qui maintient la communication des neurones.
Le rôle de la matrice extracellulaire est de plus en plus apprécié comme une variable clé dans la SEP qui peut déterminer si la remyélinisation se produira ou non après qu’elle a été endommagée.
«Dans la sclérose en plaques, on sait depuis longtemps que la cicatrisation tissulaire – littéralement, la sclérose de la SEP – est une caractéristique pathologique clé et que l’environnement, la matrice extracellulaire, orchestre la signalisation qui soutient ou entrave les processus de réparation et de régénération tissulaires, »A déclaré Fraser Sim, PhD, auteur principal des deux articles, professeur agrégé de pharmacologie et de toxicologie à la Jacobs School of Medicine and Biomedical Sciences à l’UB et directeur du programme de neurosciences. Darpan Saraswat, PhD, chercheur principal dans le laboratoire de Sim, est le premier auteur des deux publications.
«Dans des maladies telles que la SEP», a expliqué Sim, «la matrice extracellulaire subit de profonds changements. Ces changements modifient les interactions entre les cellules contribuant à un échec de la réparation ou de la remyélinisation de la myéline. »
La recherche UB s’est concentrée sur les enzymes clés impliquées dans la régulation de l’héparane sulfatation, qui joue un rôle clé dans la signalisation entre les cellules. En particulier, les chercheurs ont étudié le rôle de l’héparanome dans la remyélinisation. L’héparanome, a expliqué Sim, fait référence à la nature très complexe de la façon dont le sulfate d’héparine, un polymère glucidique modifié par sulfatation d’une manière très spécifique, apparaît à la surface d’une cellule.
« L’héparanome contribue à l’environnement de la matrice extracellulaire et régule l’activité de multiples cascades de signalisation pour influencer le comportement et la fonction des cellules dans le développement et dans la maladie », a déclaré Sim. Il a ajouté que l’héparanome régule une multitude de cascades de signalisation vitales qui régulent à la fois la réparation de la myéline et la biologie des cellules progénitrices d’oligodendrocytes (OPC), les cellules qui génèrent la myéline.
Dans l’article de Nature Communications, Sim et ses collègues montrent que le SULF2, l’une des enzymes impliquées dans la régulation de la sulfatation de l’héparane, est fortement exprimé par les OPC. Chez les patients atteints de sclérose en plaques, a-t-il dit, elle se trouve à des niveaux élevés dans les régions de démyélinisation et exerce probablement une influence profonde sur l’environnement tissulaire malade.
«Nous avons constaté que lorsque nous supprimions génétiquement le SULF2 des OPC, cela se traduisait par une remyélinisation accélérée grâce à une amélioration du recrutement et de la différenciation des OPC», a déclaré Sim.
Ils ont également découvert qu’un agent pharmacologique appelé PI-88, actuellement en essais cliniques en tant qu’agent contre divers cancers, bloque le SULF2 et est capable d’accélérer le recrutement des OPC dans les régions de démyélinisation et de favoriser la régénération de nouveaux oligodendrocytes et de la myéline.
Modifier l’héparanome
Les chercheurs ont poursuivi leur étude du PI-88 dans l’article du Journal of Neuroscience, examinant sa capacité à modifier l’héparanome dans le contexte d’un environnement tissulaire très enflammé. Ils ont constaté que PI-88 pouvait améliorer la remyélinisation même après l’arrêt du processus de réparation médié par les OPC par la perfusion de la cytokine interféron-g pro-inflammatoire, ce qui entraîne une démyélinisation chronique et une dégénérescence axonale qui caractérisent les formes progressives de SEP.
Sim et ses collègues ont récemment reçu une subvention du ministère de la Défense qui leur permettra de continuer à explorer le PI-88 en tant que traitement potentiel de la SEP.
«Ces deux publications mettent en évidence un nouveau rôle de l’héparanome dans la régulation de la remyélinisation», a déclaré Sim. La recherche suggère que des molécules telles que PI-88, qui peuvent modifier à la fois l’équilibre de la production de sulfate d’héparine et la sulfatation globale, sont des cibles attrayantes pour les thérapies régénératives dans la SEP et d’autres maladies démyélinisantes.
Une cible telle que l’héparanome, qui influence tant d’aspects du comportement et de la fonction cellulaires, offre une approche efficace pour aborder les multiples voies impliquées dans la démyélinisation de la SEP.
«Notre caractérisation du rôle de l’héparanome dans la SEP et la découverte qu’il est possible de le moduler avec une puissante petite molécule sont des preuves encourageantes que nous pourrions être sur quelque chose de pertinent dans le contexte de la découverte de médicaments», a déclaré Sim.
La source: Université d’État de New York à Buffalo