Salmonella est au centre d’une énigme scientifique qui intrigue les chercheurs depuis plus de 20 ans.
L’agent pathogène est bien connu pour causer des maladies d’origine alimentaire et peut infecter les gens par le biais d’aliments ou d’eau contaminés. Mais jusqu’à récemment, personne ne savait comment le microbe – dont les souches peuvent également provoquer la fièvre typhoïde et l’arthrite post-infectieuse – manipule une classe fondamentale de lipides cellulaires appelés phosphoinositides.

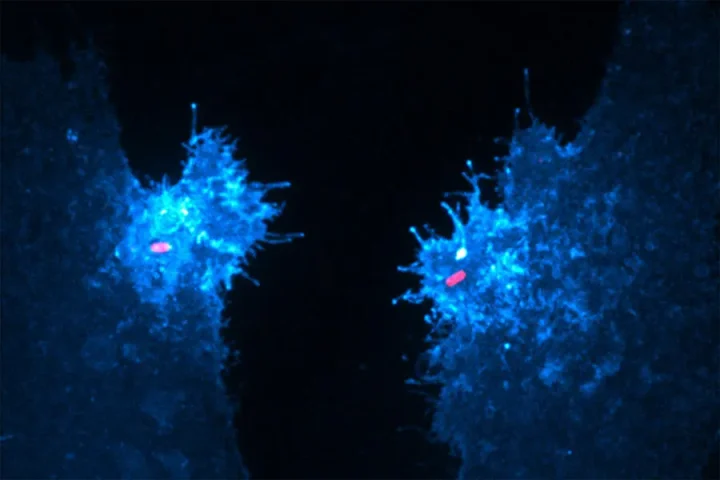
Des cellules épithéliales humaines exprimant un biocapteur fluorescent spécifique du lipide (bleu) ont été exposées à des salmonelles invasives (rouge). Crédit image : Université de Toronto
Glenn Walpole, un MD/Ph.D. étudiant à la faculté de médecine Temerty de l’Université de Toronto fait partie d’une équipe qui a résolu le mystère. Leur étude a été publiée dans la revue Biologie Cellulaire Nature et présenté sur la couverture de son numéro de mai.
Walpole a parlé avec l’écrivain Erin Howe sur les découvertes.
Parlez-nous de votre recherche et de la question à laquelle vous avez décidé de répondre avec cette étude.
Pendant mon doctorat. études au département de biochimie, j’ai exploré comment différents microbes interagissent avec les cellules humaines.
Il existe de bons microbes qui aident à façonner le développement de notre système immunitaire, de notre métabolisme et de plusieurs autres voies importantes. Mais mes recherches se sont concentrées sur le petit sous-ensemble de microbes qui causent des maladies, qui sont nocifs pour les humains et qui peuvent être nocifs pour les animaux. C’est le cas de la salmonelle.
Les chercheurs utilisent souvent la salmonelle comme système modèle pour les agents pathogènes intracellulaires, qui peuvent envahir les cellules hôtes et résider à l’intérieur des compartiments spécialisés qu’ils y créent.
Ces microbes intracellulaires sécrètent des protéines spécialisées dans les cellules humaines qui manipulent notre biologie, ce qui permet aux agents pathogènes de créer une niche où ils peuvent extraire des nutriments, se développer, se répliquer et même se propager à d’autres cellules de notre corps. Plusieurs agents pathogènes sont capables de ce type de comportement, ce qui est un défi pour notre système immunitaire à reconnaître et à éliminer.
Des formes résistantes aux antibiotiques de nombreux agents pathogènes qui s’adaptent à ce mode de vie intracellulaire ont récemment été notées dans la littérature scientifique ; cela ajoute à notre préoccupation, étant donné que les agents pathogènes intracellulaires sont une cause importante de décès et de maladies dans le monde.
Pendant mon doctorat, mes superviseurs et mentors (Sergio Grinsteinchercheur principal à l’Hospital for Sick Children et professeur au département de biochimie de la faculté de médecine de Temerty ; Jean Brumel codirecteur du Centre des maladies inflammatoires de l’intestin à SickKids et professeur de génétique moléculaire à l’U de T; et Greg Fairnqui travaille maintenant au département de pathologie de l’Université Dalhousie) et je voulais étudier les premiers stades de l’infection – lorsque l’agent pathogène envahit les cellules qui tapissent le tractus gastro-intestinal et s’y établissent.
Nous nous sommes intéressés aux lipides qui font partie de la membrane entourant chaque cellule de notre corps et à la façon dont la salmonelle manipule les lipides appelés phosphoinositides.
Il y a environ 20 ans, des recherches ont montré que lorsque la salmonelle infecte une cellule, elle active les voies de signalisation de l’hôte qui dépendent des lipides phosphoinositides. La cellule hôte est “trompée” pour survivre malgré la présence d’un pathogène nocif à l’intérieur, ce qui permet à la bactérie de se développer et de se répliquer.
Des voies de survie similaires vont de travers dans plusieurs types de cancer. C’est presque comme si les bactéries imposaient une caractéristique cancéreuse à la cellule, en manipulant les phosphoinositides. C’est ce que nous voulions comprendre, car la façon dont la salmonelle faisait cela était restée un véritable mystère dans notre domaine.
Deux cellules épithéliales humaines [that] expriment un biocapteur fluorescent spécifique du lipide (en bleu) ont été exposés à des salmonelles invasives (en rouge). Dans leur étude, Walpole et ses collaborateurs révèlent que ce lipide, qui soutient l’entrée bactérienne et la survie de l’hôte, est généré par une réaction de phosphotransférase non conventionnelle pilotée par la protéine de salmonelle sécrétée SopB.
Des cellules épithéliales humaines exprimant un biocapteur fluorescent spécifique du lipide (bleu) ont été exposées à des salmonelles invasives (rouge).
Alors, qu’avez-vous découvert, vous et l’équipe ?
Nous avons découvert que la salmonelle sécrète une protéine appelée SopB, qui est comme un petit soldat qui pénètre dans la cellule et manipule les phosphoinositides par une réaction enzymatique spécialisée. La réaction que SopB effectue sur le lipide, appelée réaction de phosphotransférase, n’avait jamais été décrite pour aucune enzyme humaine ou bactérienne avant cette étude.
Ces nouvelles connaissances constituent une avancée dans les domaines des interactions hôte-pathogène et de la biologie cellulaire. Les implications sont également très intéressantes en termes de biologie humaine.
Quelles nouvelles voies cette découverte ouvre-t-elle ?
Il y a deux nouvelles avenues que nous pouvons explorer à partir d’ici. Le premier est l’application directe au processus d’infection. En découvrant une nouvelle réaction enzymatique, il existe désormais une nouvelle cible de traitement. Des recherches supplémentaires pourraient aider les scientifiques à découvrir ou à développer de nouveaux antibiotiques pour cibler cette réaction enzymatique spécifique.
Et dans ce sens, nous avons également découvert qu’une protéine apparentée sécrétée par un agent pathogène différent – Shigella, qui provoque également une diarrhée sévère – semble avoir la capacité d’effectuer le même type de réaction. Ainsi, nous pourrions cibler cette réaction lors d’infections à salmonelle, mais potentiellement aussi pour d’autres agents pathogènes.
La deuxième grande possibilité soulevée par cette étude est de savoir si la réaction enzymatique que nous avons découverte se produit également dans les cellules humaines au quotidien en l’absence d’infection et que nous ne l’avons tout simplement jamais réalisé.
Les chercheurs qui travaillent dans ce domaine ont soigneusement noté les principales voies supposées être impliquées dans la formation de ces lipides telles que les PI3-kinases, une autre classe d’enzymes hôtes. Mais nos découvertes bouleversent notre compréhension antérieure. Par exemple, plusieurs de ces enzymes comme les PI3-K sont à l’origine de certaines formes de cancer. Ainsi, si des enzymes humaines effectuent cette réaction supplémentaire de phosphotransférase, cela pourrait changer notre façon de penser à cette voie de signalisation dans le cancer.
Quelle a été la réponse à votre recherche jusqu’à présent ?
La réponse de la communauté scientifique a été extrêmement positive. Par le biais des médias sociaux, par exemple, les gens interagissent avec le journal et nous envoient des questions et des ondes positives du monde entier, ce qui est vraiment cool. C’est bien de voir les commentaires d’autres chercheurs, soit dans le domaine de l’hôte-pathogène, soit qui étudient les phosphoinositides dans le contexte du cancer ou du diabète.
De plus, lorsque nous avons téléchargé cette histoire dans son format préimprimé, nous avons reçu une invitation un jour plus tard pour présenter lors d’une série de séminaires zoom mondiaux. J’ai également présenté ce travail au Symposium de biologie cellulaire de l’Ontario, et nous avons été acceptés pour présenter à Lisbonne, au Portugal, l’été prochain. Je pense que le domaine est enthousiasmé par ce que nos découvertes signifient non seulement pour les interactions hôte-pathogène, mais aussi pour les nombreux autres processus que les phosphoinositides régulent.
Comme c’est excitant de faire ce genre de vagues alors que vous êtes encore en train de terminer votre MD/Ph.D. programme?
C’est très excitant, mais il est important de se rappeler qu’un effort comme celui-ci était vraiment comme faire partie d’une équipe de football. En plus de mes superviseurs, un de mes collaborateurs et mentors très important était notre auteur principal, Fairn. Il a apporté une grande partie de l’expertise technique et de la créativité dont nous avions besoin pour prouver une question aussi difficile.
Et parfois, il y a un peu de sérendipité dans la science qui n’est pas capturée dans les publications. Les gens se sont posé cette question pendant 20 ans depuis que certains des premiers travaux ont été publiés. Il a fallu de la persévérance pour répondre à cette question, mais cela a également exigé l’application prudente d’outils qui n’existaient pas il y a deux décennies.
Nous avons collaboré avec un groupe de l’Université de Pittsburgh pour faire de l’optogénétique avec cette enzyme, afin de pouvoir activer l’enzyme à la demande avec une lumière à haute énergie. Cela nous a permis de voir, minute par minute, ce qui s’est passé lorsque nous avons activé l’enzyme. Cette méthode n’est devenue disponible qu’au cours des dernières années.
Nous avons également fait un type d’analyse des lipides appelé spectrométrie de masse avec un groupe en Angleterre à l’Institut Babraham. Cette approche d’analyse du sous-ensemble de phosphoinositides qui nous intéressait a été développée par ce groupe et publiée il y a seulement environ deux ans. Les résultats de cette étude sont vraiment le résultat des efforts de nombreuses personnes.
Et ce qui vous a attiré vers le MD/Ph.D. programme?
Le jumelage des études de médecine avec la recherche doctorale offre une perspective vraiment unique pour voir chaque domaine. De nombreuses connaissances fondamentales sur la façon dont les gens développent et vivent la maladie et la maladie proviennent de la clinique. Les médecins-chercheurs peuvent aller de l’avant et poser des questions de recherche significatives et importantes à partir de cette optique. Et ici à Temerty Medicine, il y a des chercheurs dans pratiquement tous les domaines imaginables de la recherche en santé. La productivité est extraordinaire.
Quelle est la prochaine pour vous?
Je termine ma deuxième année dans le programme de médecine à la fin du mois et j’attends avec impatience le soleil cet été, un voyage au Portugal et un stage dans quelques mois. Je vais aussi plonger dans un nouveau domaine de recherche avec Robert Inman et Nigil Haron [both physicians in the University Health Network and faculty in rheumatology in the Temerty Faculty of Medicine] au Schroeder Arthritis Institute dans les mois à venir.
La source: Université de Toronto