La plupart des cœurs humains semblent presque identiques – des cellules musculaires aux mêmes endroits, des structures de vaisseaux sanguins dans les mêmes orientations. Les organes tels que le cœur ou l’estomac se ressemblent et fonctionnent de la même manière dans tous les organismes individuels d’une espèce, car les cellules suivent des processus rigoureux au cours du développement qui les amènent précisément là où elles doivent aller.

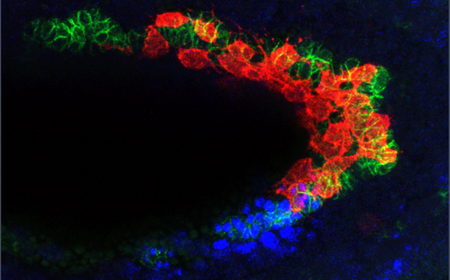
Les cellules CVM (rouges) suivent une piste constituée de cellules TVM (vertes). Les cellules TVM émettent un signal, indiquant aux cellules CVM qu’elles vont dans la bonne direction. Les cellules CVM approchent d’un virage dans l’embryon où elles rencontreront des signaux BMP élevés (bleus), ce qui indiquera que CVM doit se répliquer et se multiplier. La signalisation BMP déclenche également l’expression d’un gène “toxique”, appelé hid, et à moins que les cellules en prolifération adhèrent étroitement à la piste TVM, hid les tuera. De cette façon, l’embryon en développement effectue un contrôle de qualité, s’assurant que toutes les cellules capricieuses sont éliminées. Crédit image : F. Macabenta
Le processus de développement implique d’innombrables étapes qui doivent se dérouler dans un ordre et une mode exacts. L’étude de ces étapes complexes est au centre du laboratoire de Caltech Angela Stathopoulos, professeur de biologie. Le laboratoire utilise des mouches des fruits, qui ont un cycle de développement de 24 heures avec des changements significatifs observables presque toutes les minutes, comme système modèle.
Un nouvel article du laboratoire Stathopoulos examine les cellules du mésoderme viscéral caudal (CVM), qui finiront par devenir des fibres musculaires dans l’intestin de la mouche des fruits. Ces cellules migrent de l’arrière de l’embryon en développement vers l’avant en six heures – la plus longue distance de migration de toute l’embryogenèse de la mouche des fruits.
La nouvelle recherche identifie les mécanismes qui garantissent que toute cellule capricieuse et errante s’autodétruira par une forme spécifique de mort cellulaire appelée anoïkis. Fait intéressant, la résistance à anoïkis est un précurseur de nombreux cancers métastatiques. Comprendre les voies qui guident la santé anoïkis peut finalement donner un aperçu de la façon dont les cancers métastasent et pourquoi ils envahissent certaines parties du corps.
“La mort cellulaire est une partie normale et saine du développement”, explique Stathopoulos. « La cellule migrante doit constamment prendre des décisions et déterminer si elle se trouve au bon endroit dans le corps. S’il n’est pas au bon endroit, il doit s’autodétruire. Nous avons maintenant déterminé les voies par lesquelles la cellule peut le faire.
Le papier apparaît en ligne dans le journal Cellule de développement. Frank Macabenta, associé de recherche postdoctoral senior en biologie et génie biologique à Caltech, est le premier auteur de l’étude.
Les cellules CVM ne font pas leur long voyage à travers l’embryon de mouche des fruits seuls. Ces 40 à 50 cellules suivent une sorte de piste constituée d’un type cellulaire différent appelé mésoderme viscéral du tronc (TVM). Les cellules TVM émettent un signal chimique appelé facteur de croissance des fibroblastes (FGF), qui permet à une cellule CVM de savoir qu’elle est au bon endroit.
Au milieu de leur migration, les cellules CVM doivent naviguer autour d’un virage serré dans l’embryon, à peu près en forme de U. À ce stade, les cellules CVM commencent à proliférer en prévision d’être bientôt à la fin de leur voyage, quand il sera temps de commencer à développer leurs muscles. Le problème est que lorsque les cellules commencent à se multiplier, certaines commencent à dériver hors de la piste TVM. Les chercheurs ont précédemment observé que c’est le point où ces cellules perdues subiront anoïkis et l’autodestruction.
Un gène appelé caché (abréviation d’involution de la tête défectueuse) est responsable de anoïkis. Lorsque caché est exprimé dans une cellule, la cellule mourra. Dans le nouveau travail, Macabenta a découvert que les cellules CVM commencent à exprimer caché lorsqu’ils tournent dans le virage de l’embryon, mais ils ne meurent pas, à moins qu’ils ne tombent de la piste TVM.

Les cellules CVM (blanches) migrent autour d’un coude dans l’embryon. Quand ils font ce tour, ils commencent à proliférer et à se multiplier. Crédit image : F. Macabenta
L’équipe a découvert que cela était possible grâce aux signaux FGF, qui agissent comme antidote à caché: Si une cellule tombe hors de la voie et arrête donc de recevoir des signaux FGF, elle mourra ; il peut rester en vie malgré caché s’exprime tant qu’il reste sur la bonne voie. De cette façon, l’embryon peut s’assurer que toutes les cellules capricieuses s’autodétruiront, tandis que les cellules fonctionnant correctement seront épargnées.
Enfin, l’équipe a également découvert qu’une voie particulière, appelée voie de la protéine morphogénétique osseuse (BMP), contrôle le moment où les cellules commencent à proliférer. La signalisation BMP commence juste au moment où les cellules naviguent dans le virage en forme de U, à peu près au milieu de leur migration. C’est ce signal qui permet aux cellules de se diviser et de croître en nombre.
Les cellules ont une « horloge » interne, connue sous le nom de cycle cellulaire, qui contrôle le moment de la croissance, la réplication de l’ADN et la division cellulaire (mitose). L’équipe a constaté que le moment de caché l’expression est liée à la progression du cycle cellulaire, et lorsque celui-ci est perturbé, caché n’est plus exprimé au bon moment lors de la migration cellulaire. La signalisation BMP est nécessaire pour permettre au cycle cellulaire d’avancer à travers la mitose et est donc également nécessaire pour chronométrer l’expression précise de cachécar les cellules qui ne parviennent pas à se diviser ne sont pas capables d’exprimer caché rapidement pour éliminer les cellules perdues.
Il est crucial que les cellules puissent avoir ces mécanismes de contrôle de qualité programmés car les cellules capricieuses peuvent nuire au bon développement du reste de l’organisme.
“Lorsque nous avons retiré le caché gène, les cellules qui se sont écartées de la piste survivraient et finiraient par envahir et perturber le système nerveux central, là où elles ne devraient vraiment pas se trouver », explique Macabenta. «Ils ne sont plus sur la bonne voie, alors ils reviennent à une sorte de« plan B »où ils trouvent un endroit pour lequel ils ont des affinités. Si vous regardez les autopsies de personnes qui ont eu un cancer métastatique, les cellules métastasantes vont généralement coloniser des endroits spécifiques. Notre recherche sert de système pour comprendre, espérons-le, comment cela fonctionne, comment les cellules tournent mal et déterminer les signaux de « second choix » à suivre. Dans des travaux futurs, nous aimerions voir quels autres signaux ou signaux suivent les cellules CVM qui les conduisent au système nerveux central. Cela pourrait expliquer pourquoi certains types de métastases colonisent préférentiellement d’autres tissus.
Écrit par Lori Dajose
La source: Caltech