En suivant la rétroaction pendant les tâches, le cortex cingulaire antérieur remarque quand une nouvelle étape est devenue nécessaire et signale au cortex moteur de s’adapter.
La vie est pleine de processus à apprendre puis à réapprendre quand ils deviennent plus élaborés. Un jour, vous vous connectez à une application avec juste un mot de passe, le lendemain, vous avez également besoin d’un code qui vous est envoyé par SMS. Un jour, vous pouvez simplement mettre votre déjeuner préféré au micro-ondes dans le four pendant six minutes consécutives, mais ensuite l’emballage change et vous devez le faire cuire pendant trois minutes, remuer, puis le chauffer pendant trois autres minutes.
Notre cerveau a besoin d’un moyen de suivre le rythme. Une nouvelle étude menée par des neuroscientifiques de l’Institut Picower pour l’apprentissage et la mémoire du MIT révèle certains des circuits qui aident un cerveau de mammifère à apprendre à ajouter des étapes.

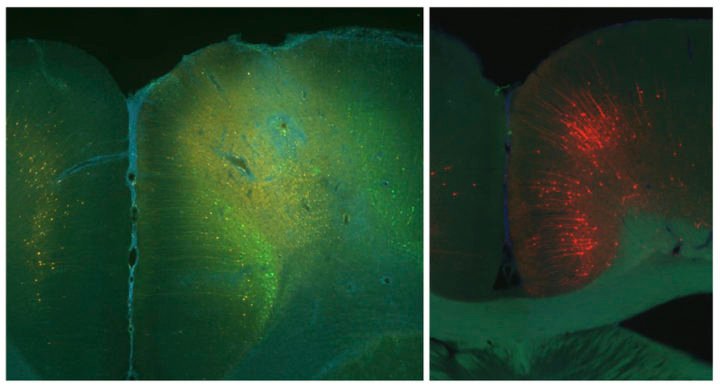
Légende : Dans leur étude, les chercheurs ont tracé des neurones se projetant du cortex cingulaire antérieur (droit, rouge) vers le cortex moteur (gauche, vert). Notez que les images sont à différentes échelles. Crédit image : Daigo Takeuchi/Institut PIcower
Dans Communication Nature les scientifiques rapportent que lorsqu’ils ont modifié les règles d’une tâche, obligeant les rats à passer d’une seule étape à deux, une paire de régions à la surface du cerveau, ou cortex, ont collaboré pour mettre à jour cette compréhension et modifier le comportement des rats. s’adapter au nouveau régime. Le cortex cingulaire antérieur (ACC) a semblé reconnaître quand les rats n’en faisaient pas assez et a mis à jour les cellules du cortex moteur (M2) pour ajuster le comportement de la tâche.
“J’ai commencé ce projet il y a environ sept ou huit ans lorsque je voulais étudier la prise de décision”, explique Daigo Takeuchi, chercheur à l’Université de Tokyo qui a dirigé les travaux en tant que postdoctorant au laboratoire RIKEN-MIT pour la génétique des circuits neuronaux à l’Institut Picower, dirigé par l’auteur principal et professeur Picower Susumu Tonegawa. « De nouvelles études trouvaient un rôle pour M2. Je voulais étudier quels circuits en amont influençaient cela.
Décrocher la deuxième étape
Takeuchi et Tonegawa ont tracé les connexions des circuits neuronaux qui menaient à M2 et ont découvert que beaucoup provenaient de l’ACC. Ils ont commencé à voir le rôle de l’ACC dans l’orientation des décisions séquentielles de M2 lorsqu’ils ont instillé une manipulation génétique dans les cellules ACC qui leur a permis de supprimer leur activité. Cette désactivation « chimiogénétique » de l’ACC a eu un effet particulier. Lorsque les règles de la tâche ont changé de sorte qu’au lieu d’avoir à enfoncer leur museau dans un seul trou pour obtenir une petite récompense, les rats ont dû enfoncer leur nez dans une séquence de deux trous, les rongeurs avec des ACC silencieux ont mis beaucoup plus de temps à réaliser le changement de règle . Comparés aux rats avec une activité ACC normale, ils n’ont pas réussi à réaliser que le deuxième coup était nécessaire pendant beaucoup plus longtemps. Les rats n’ont eu aucun mal, cependant, à passer de deux pas en arrière à un seul, que leur ACC ait été réduit au silence ou non.
Lorsque les scientifiques ont chimiogénétiquement réduit au silence les terminaux des cellules ACC dans M2, ils ont obtenu les mêmes résultats qu’en faisant taire l’ACC dans son ensemble. Ils ont également réduit au silence d’autres zones du cortex, mais cela n’a pas affecté la capacité des rats à remarquer et à s’adapter au changement de règle. Ensemble, ces manipulations ont confirmé que ce sont spécifiquement les connexions de l’ACC avec M2 qui aident les rats à remarquer et à s’adapter au changement d’une étape à deux étapes.
Mais quel effet l’ACC a-t-il en M2 ? Takeuchi et ses co-auteurs ont mesuré l’activité électrique des cellules dans M2 pendant que les rats jouaient à leur jeu de piqûre de nez et de changement de règles. Ils ont découvert que de nombreuses cellules étaient particulièrement activées par différentes règles de tâche (c’est-à-dire une étape ou deux étapes). Quand ils ont fait taire l’ACC, cependant, cela a supprimé cette sélectivité des règles.
Au sein de M2, Takeuchi et l’équipe ont également remarqué des populations de neurones qui répondaient préférentiellement aux résultats positifs (récompense pour avoir bien fait la tâche) et aux résultats négatifs (ne pas recevoir de récompense pour avoir mal fait la tâche). Ils ont découvert que lorsqu’ils faisaient taire l’ACC, cela augmentait en fait l’activité des neurones codant les résultats négatifs pendant la rétroaction négative, en particulier pour les 10 à 20 premiers tours après que les règles soient passées d’une étape à deux. Cela était fortement corrélé avec le moment, ou «l’époque», de la pire performance des rats.
“Il semble probable que la perturbation spécifique à l’époque des performances de deuxième choix des animaux soit associée à l’amélioration excessive de l’activité des neurones activés par les résultats négatifs causée par le silence de l’ACC”, ont-ils écrit dans l’étude.
L’équipe a en outre confirmé que l’étape de la rétroaction, ou des résultats, importait en utilisant une technique différente pour faire taire l’ACC. En concevant des neurones ACC pour qu’ils soient supprimés par des éclairs de lumière (une technique appelée «optogénétique»), ils pourraient contrôler avec précision le moment où l’ACC se déconnecte. Ils ont découvert que s’ils le faisaient après que les rats aient fait un mauvais choix lorsque les règles passaient d’un coup à deux, ils pouvaient continuer à faire errer les rats. Le silence optogénétique de l’ACC après que les rats ont fait un choix correct n’a pas compromis leur comportement ultérieur.
“Ces résultats indiquent que les neurones ACC traitent les informations de rétroaction d’erreur suite à une deuxième réponse erronée et utilisent ces informations pour ajuster les réponses de choix séquentiel de l’animal lors d’essais ultérieurs”, ont-ils écrit.
Un seuil trop élevé
Les preuves ont brossé un tableau clair : lorsque les rats ont eu besoin de remarquer qu’une étape supplémentaire était désormais nécessaire, le travail de l’ACC était d’apprendre de la rétroaction négative et de signaler à M2 de faire la deuxième étape. Si l’ACC n’était pas disponible lorsque la rétroaction était fournie, alors les cellules M2 qui mettent l’accent sur les résultats négatifs deviendraient apparemment particulièrement actives et les rats ne parviendraient pas à faire la deuxième étape requise pendant un certain temps avant de finalement comprendre.
Pourquoi moins d’activité ACC augmenterait-elle d’une manière ou d’une autre le résultat négatif codant l’activité des cellules dans M2 ? Takeuchi émet l’hypothèse que ce que fait réellement l’ACC est de stimuler les cellules inhibitrices de M2 qui modulent normalement l’activité de ces cellules. Avec une activité ACC réduite, le résultat négatif codant pour les cellules M2 subit moins d’inhibition. Le résultat comportemental, théorise-t-il, est que les rats ont donc besoin de plus de preuves qu’ils ne le devraient du changement de règle. Le mécanisme n’est pas tout à fait clair, a reconnu Takeuchi, mais les rats ont apparemment besoin de plus de temps pour faire l’expérience de la rétroaction des résultats après avoir pris la bonne décision de faire un deuxième pas avant qu’ils ne soient convaincus qu’ils sont sur la bonne voie en le faisant.
Takeuchi dit que si les résultats démontrent le circuit nécessaire pour s’adapter à un changement de règle nécessitant plus d’étapes dans un processus, cela soulève également de nouvelles questions intéressantes. Existe-t-il un autre circuit pour remarquer quand un processus en plusieurs étapes est devenu un processus en une étape ? Si oui, ce circuit est-il intégré à celui dont il est question dans cette étude ? Et si le modèle de seuil est le bon, comment fonctionne-t-il exactement ?
Les implications sont non seulement importantes pour comprendre la base neurale des décisions séquentielles naturelles, mais peuvent également concerner les applications d’IA allant du jeu au travail industriel, chacune pouvant impliquer des tâches à plusieurs étapes.
Écrit par David Orenstein
La source: Massachusetts Institute of Technology