La maladie d’Alexander est un trouble neurologique évolutif et rare sans remède ni traitement standard. Mais une nouvelle étude menée par des chercheurs de l’Université du Wisconsin-Madison impliquant un modèle de rat de la maladie offre un traitement potentiel pour la maladie généralement mortelle.
Il s’agit d’une étape importante dans les efforts visant à aider les personnes atteintes de la maladie, déclare Tracy Hagemann, scientifique principale de l’UW-Madison Waisman Center, qui a dirigé l’étude aux côtés d’Albee Messing, professeur émérite de biosciences comparatives et fondateur du laboratoire de la maladie d’Alexander. Avec son collègue Michael Brenner de l’Université d’Alabama à Birmingham, Messing a découvert le gène responsable de la maladie d’Alexander il y a plus de 20 ans.

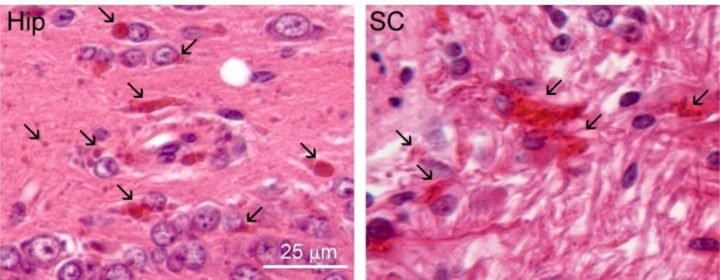
Une caractéristique de la maladie d’Alexander est l’accumulation de protéines anormales appelées fibres de Rosenthal, illustrées ici (en rouge) dans le tissu cérébral d’une étude d’un modèle de rat de la maladie. L’étude a identifié un traitement potentiel et a permis de fournir des données précoces pour un essai clinique humain en cours. Crédit image : Tracy Hagemann et al.
Les personnes nées avec la maladie d’Alexander peuvent développer une hypertrophie du cerveau et de la tête, avoir des convulsions ou un développement retardé, avoir des raideurs dans les bras et les jambes et avoir une déficience intellectuelle. La maladie, qui implique la destruction de la substance blanche du cerveau, n’est souvent diagnostiquée que lorsque les symptômes sont prononcés, explique Hagemann.
La nouvelle étude, publiée dans Science Translational Medicine, a fourni des données préliminaires utiles pour un essai clinique sur l’homme actuellement dirigé par Ionis Pharmaceuticals. Hagemann, Messing et l’Alexander Disease Lab ne sont pas directement impliqués.
Cependant, en travaillant avec Ionis Pharmaceuticals, les chercheurs ont développé un traitement composé de petits morceaux d’ADN appelés oligonucléotides antisens, qui, dans leur modèle de rat, étaient capables de cibler l’ARNm dans les cellules et de marquer l’ARNm pour la destruction, l’empêchant ainsi de créer des protéines.
Une caractéristique de la maladie d’Alexander est la formation d’agrégats de protéines anormaux appelés fibres de Rosenthal, causées par des mutations dans le gène qui produit une protéine appelée GFAP. Le lien entre cette GFAP anormale et la destruction de la substance blanche observée dans la maladie d’Alexander n’est pas encore clair, mais les modifications de la protéine font partie intégrante de la maladie dans presque tous les cas.
Des études avec un modèle murin développé par Hagemann, Messing et leurs collaborateurs, et publiées il y a trois ans, ont montré que les oligonucléotides antisens étaient capables de réduire la GFAP et d’éliminer les fibres de Rosenthal. Cependant, les souris ne présentent que des symptômes subtils de la maladie d’Alexander et les chercheurs ne peuvent pas mesurer les améliorations importantes du comportement ou de la qualité de vie qui peuvent résulter du traitement.
L’équipe de recherche a pu développer un modèle de rat qui représente mieux les dommages à la substance blanche et les manifestations physiques observés chez l’homme. Le modèle offre également de meilleures opportunités pour évaluer l’amélioration des symptômes en réponse au traitement par oligonucléotides antisens.
“La maladie d’Alexandre est considérée comme une leucodystrophie, où des déficits de la substance blanche se développent, et nous ne voyons aucune preuve de cela ou d’une déficience motrice dans le modèle murin”, explique Hagemann. « Donc, pour un modèle préclinique, les rats sont bien améliorés par rapport aux souris. »
Les rats traités avec des oligonucléotides antisens avant qu’ils ne développent des symptômes physiques majeurs sont restés pratiquement indiscernables de leurs congénères en bonne santé. Lorsque le traitement a commencé après que les rats aient été gravement affaiblis, leurs symptômes se sont non seulement considérablement améliorés; ils ont également subi une inversion de certains des dommages causés à leur substance blanche.
Les oligonucléotides antisens, explique-t-elle, « éliminent les agrégats GFAP (ou fibres de Rosenthal), et non seulement pouvons-nous empêcher la maladie de se produire en traitant les animaux à un stade précoce avant qu’ils ne présentent vraiment des signes cliniques significatifs, nous pouvons les traiter. quand ils sont au plus mal et constatent une inversion de certains des phénotypes de la maladie.
Chez les gens, dit Hagemann, « nous serons heureux si nous pouvons arrêter la progression de la maladie. Mais si vous pouvez réellement voir une inversion des symptômes qui se sont déjà produits, ce serait merveilleux. »
En plus de créer une base pour les essais cliniques, le modèle du rat a également ouvert la voie à l’étude d’aspects de la maladie qui ne sont pas encore compris, note Hagemann, y compris la première opportunité d’étudier le lien entre les mutations GFAP et les déficits de la substance blanche dans mammifères.
Ces développements ont été possibles grâce aux travaux approfondis de Messing sur la maladie d’Alexander au cours des 25 dernières années, ainsi qu’aux contributions de collègues du monde entier, ajoute Hagemann. « Le dévouement et l’engagement de Messing envers la recherche sur la maladie d’Alexander ont énormément approfondi notre compréhension de la maladie ».
La source: L’universite de Wisconsin-Madison